แบบจำลองอะตอม ตามทฤษฏี มีอยู่ 5 แบบ คือ
สสารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุดเรียกว่า อะตอม ซึ่งไม่สามารถแบ่งแยกต่อไปได้อีก
2. แบบจำลองอะตอมของทอมสัน - ค้นพบอิเล็กตรอน ที่ มีประจุไฟฟ้าลบ มีมวลประมาณ1/2000 ของมวลของ H
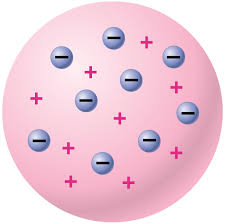
- โดยศึกษาพฤติกรรมของ หลอดรังสีแคโทด ในสนามแม่เหล็กไฟฟ้า
3. แบบจำลองของรัทเทอร์ฟอร์ด
การกระเจิง (scattering) ของอนุภาค a โดยแผ่นทองคำบางๆ
รัทเทอร์ฟอร์ดพบว่ารังสีส่วนใหญ่ไม่เบี่ยงเบน และส่วนน้อยที่เบี่ยงเบนนั้น ทำมุมเบี่ยงเบนใหญ่มาก บางส่วนยังเบี่ยงเบนกลับทิศทางเดิมด้วย จำนวนรังสีที่เบี่ยงเบนจะมากขึ้นถ้าความหนาแน่นของแผ่นโลหะเพิ่มขึ้น
อนุภาคมูลฐาน
อนุภาค
|
ประจุ(หน่วย)
|
ประจุ(C)
|
มวล(g)
|
มวล(amu)
|
อิเล็กตรอน
|
-1
|
1.6 x 10-19
|
0.000549
|
9.1096 x 10-28
|
โปรตรอน
|
+1
|
1.6 x 10-19
|
1.007277
|
1.6726 x 10-24
|
นิวตรอน
|
0
|
0
|
1.008665
|
1.6749 x 10-24
|
การเขียนสัญลักษณ์นิวเคลียร์
AZX : เลขมวล คือผลบวกของโปรตอน และนิวตรอนในนิวเคลียส
เลขอะตอม คือ จำนวนโปรตอนในนิวเคลียส ซึ่ง =จำนวนอิเล็กตรอนในอะตอม
ตัวอย่าง การเขียนสัญลักษณ์นิวเคลียร์
ดังนั้น อะตอมของธาตุLithium ( Li ) มีจำนวนโปรตอน = 3 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
คำศัพท์ที่ควรทราบ
1. ไอโซโทป ( Isotope )
หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน
2. ไอโซบาร์ ( Isobar )
หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน
3. ไอโซโทน ( Isotone )
หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน
4. แบบจำลองอะตอมของนีลส์โบร์
นักวิทยาศาสตร์จึงมีการศึกษาข้อมูลใหม่มาสร้างแบบจำลองที่เน้นรายละเอียดเกี่ยวกับการจัดเรียงอิเล็กตรอนที่อยู่รอบนิวเคลียส โดยศึกษาจากสเปกตรัมและค่าพลังงานไอออไนเซชัน
สเปกตรัม
สเปกตรัมเป็นแสงที่ถูกแยกกระจายออกเป็นแถบสีต่าง ๆ และแสงเป็นรูปหนึ่งของคลื่นแม่เหล็กไฟฟ้า
แถบสีต่างๆในแถบสเปคตรัมของแสง
สเปกตรัม
|
ความยาวคลื่น (nm)
|
ม่วงน้ำเงินเขียวเหลืองส้มแดง
|
400 - 420420 - 490490 - 580580 - 590590 - 650650 - 700
|
สเปกตรัมของธาตุ
แมกซ์ พลังค์ได้เสนอทฤษฎีควอนตัม (quantum theory) และอธิบายเกี่ยวกับการเปล่งรังสีว่า รังสีแม่เหล็กไฟฟ้าที่เปล่งออกมามีลักษณะเป็นกลุ่มๆ ซึ่งประกอบด้วยหน่วยเล็กๆ เรียกว่า ควอนตัม (quantum) ขนาดของควอนตัมขึ้นกับความถี่ของรังสี และแต่ละควอนตัมมีพลังงาน (E) โดยที่ E เป็นปฏิภาคโดยตรงกับความถี่ (u) ดังนี้
E=hν
E = พลังงาน 1 ควอนตัมแสง(J)
h = ค่าคงที่ของพลังค์ (6.62x10-34 Js)
ν= ค่าความถี่ ( s-1)
5.แบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดีแต่ ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้จึงได้มีการศึกษาเพิ่มเติมจนได้แบบจำลองใหม่ที่เรียกว่าแบบจำลองอะตอมแบบกลุ่มหมอก
การจัดเรียงอิเล็กตรอน
ในแต่ละชั้นของระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้ ไม่เกิน 2n 2
ระดับพลังงานหลัก
|
จำนวนอิเล็กตรอนที่มีได้มากที่สุด
|
n = 1 (K)
|
2(1) 2 = 2
|
n = 2 (L)
|
2(2) 2 = 8
|
n = 3 (M)
|
2(3) 2 = 18
|
n = 4 (N)
|
2(4) 2 = 32
|
n = 5 (O)
|
2(5) 2 =50
|
n = 6 (P)
|
2(6) 2 = 72
|
n = 7 (Q)
|
2(7) 2 = 98
|
ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f
ระดับพลังงานชั้นย่อย s มี e - ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e - ได้ ไม่เกิน 6 ตัว

ไม่มีความคิดเห็น:
แสดงความคิดเห็น